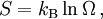
Uma expressão da Segunda Lei da Termodinâmica é que sempre que um evento espontâneo ocorre em nosso universo, ele é acompanhado por um aumento global da entropia.[1] Em termos simples, ela afirma que a entropia de um sistema isolado sempre aumentará, e uma diminuição local da entropia num sistema aberto sempre resulta em um maior aumento da entropia externa.
A segunda lei da termodinâmica abrange a capacidade do calor ou da energia dentro de um sistema de realizar trabalho. A entropia é a medida da energia de um sistema que não pode ser usada para trabalho e também é referida como a quantidade de desordem de um sistema. Com o aumento da entropia, há menos energia utilizável disponível para trabalho. De acordo com a segunda lei, um sistema isolado sempre terá um aumento de entropia e uma resultante diminuição na capacidade de realizar trabalho a medida que o tempo passa. Se dado tempo suficiente, a entropia vai chegar a um nível máximo e nenhum trabalho será possível dentro do sistema.
Quando a entropia é examinada estatisticamente ela pode ser considerada como uma medida de aleatoriedade. Quanto mais aleatório for um sistema, mais desordenado ele é. A fórmula para a entropia estatística é:
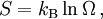
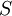 é a entropia.
é a entropia.
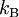 é a constante de Boltzmann = 1.380 6504(24) X 10-23 J K-1
é a constante de Boltzmann = 1.380 6504(24) X 10-23 J K-1
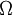 é o número de configurações equivalentes igualmente prováveis. Esta é uma medida direta da desordem.
é o número de configurações equivalentes igualmente prováveis. Esta é uma medida direta da desordem.
Sistemas aleatórios ou desordenados têm um número significativamente maior de configurações equivalentes igualmente prováveis, que podem ser basicamente considerados inevitáveis. A entropia não é o mesmo que desordem, mas a entropia está logaritmicamente relacionada a desordem. A entropia pode ser considerada como uma medida da desordem da mesma forma que a Escala Richter é uma medida dos terremotos ou os decibéis são uma medida do som.
A teoria da evolução requer alguns aumentos extremamente grandes na ordem e, portanto, uma diminuição extremamente grande da entropia. A ordem a partir do caos requer que energia seja aplicada no sistema de uma maneira organizada. O problema para a evolução é que ela carece de um mecanismo para a aplicação de energia de uma forma organizada, e isso é particularmente o caso no que diz respeito à origem da vida.
|
||||||||||||||